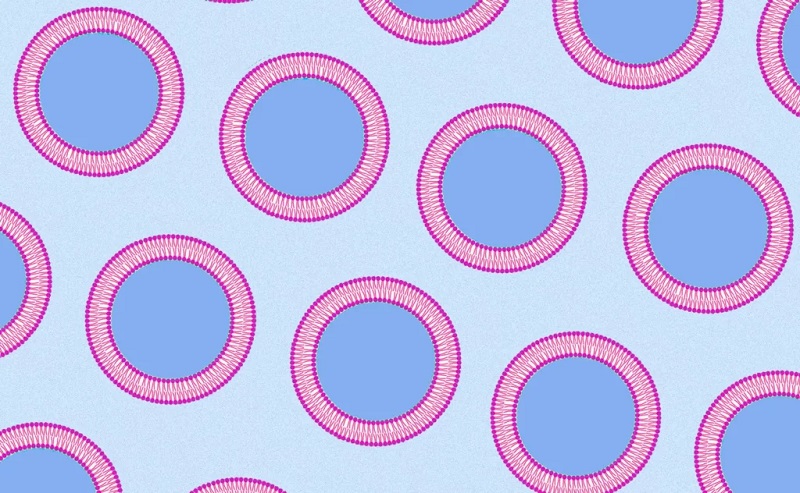

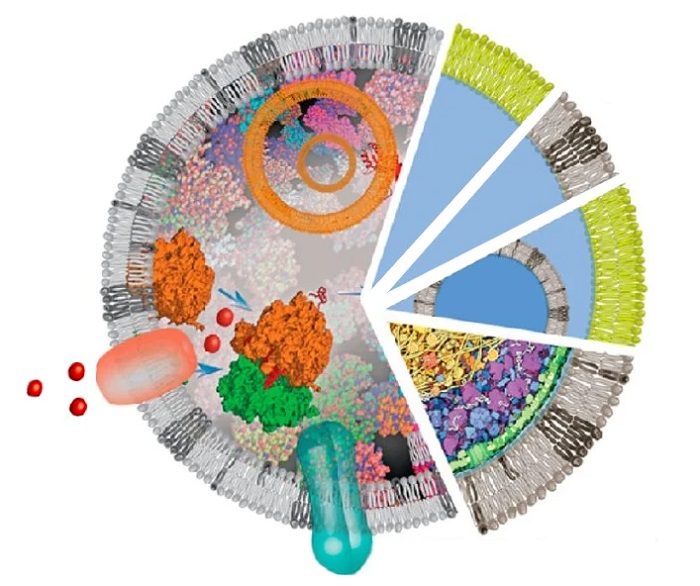
● 单分散和单层GUVS
自下而上的方法制备>1μm的仿生结构囊泡
● 自动化高通量制备
制备具有特定序列的巨型单细胞囊泡
● 良好的单分散性和可重复性
与电铸法或其他巨型GUV合成方法相比,微流控技术具有更好的控制性。
● 稳定的巨型单分子囊泡
蛋白质可以被添加到GUV膜上,而GUV膜在1个月内都是非常稳定的。
● 高度定制
该套装可结合具体的需求而进行深度定制
Cell-sized GUV picture adapted from Ho et al. (2016), double emulsion production with oleic acid by Teh, Shia-Yen, et al. (2011)
巨型单分子囊泡制备套装的优势和特点
巨型单分子囊泡GUVs的制备研究人员创建人造细胞和研究生命气源或为诊断或药物输送等前瞻性应用的合成构件的一个趋势性的热门话题。微流控技术可以实现更好的可重复性、单分散性、囊泡大小控制、封装效率和膜均匀性等,这使其成为制备GUVs的有效方法之一。
Elveflow巨型单细胞囊泡微流控合成套装包含带有流量传感器的OB1压力流量控制器,用于连续液体流量的驱动控制,您可以将其与已有的微流控芯片(或自己加工的芯片)或其他双乳液滴芯片结合使用。该套装可根据具体的需求进行高度定制。此外,借助开源的SDK文件库,Elveflow 智能软件可以轻松的与其他仪器集成在一起。该套装可应用于制备不同类型的人造细胞,包括巨型单层囊泡(GUV)或单重/双重乳液滴。
Elveflow巨型单细胞囊泡微流控合成套装可以帮助您轻松制备稳定的单分子巨型囊泡。借助开放的SDK库文件,Elveflow软件可以很容易的与其他仪器实现集成,由于OB1设备的TTL端口,还可以实现自动化序列与光学显微镜的同步。
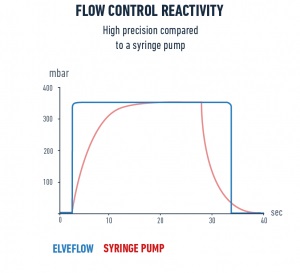
Elveflow OB1 MK3+压力流量控制器提供完全无脉冲和快速响应的流体流量控制,与流量传感器MFS或BFS相结合时,实现稳定的恒定流量驱动控制。与注射泵和蠕动泵相比,OB1恒压泵具有更快的响应速度和稳定性。

微流控GUV的制备方法是基于微流控双乳液滴合成方法的,微流控技术可以获得单分散性的稳定双乳液滴。合成双乳液滴用的芯片,可以采用PDMS芯片、塑料芯片、玻璃芯片或者同轴毛细管芯片等。
在获得双乳液滴后,有一个必要的步骤。例如,如果您创建了一个油酸和乙醇的双乳液,那么双乳液应该在30%的乙醇溶液中放置15小时,以溶解油酸,从而只剩下脂质分子。一旦巨型单体分子形成后,便可以在脱湿步骤后回收。
获得巨型单分子囊泡的一个关键步骤是通过改变材料的表面特性使微流控芯片的不同区域具有亲水特性或者疏水特性。有关通道表面的亲水或疏水改性的处理,请随时联系我们咨询。
Elveflow巨型单细胞囊泡微流控合成套装包含几个主要的仪器组件,每个组件都与其他组件相兼容。连接示意图如下图所示。
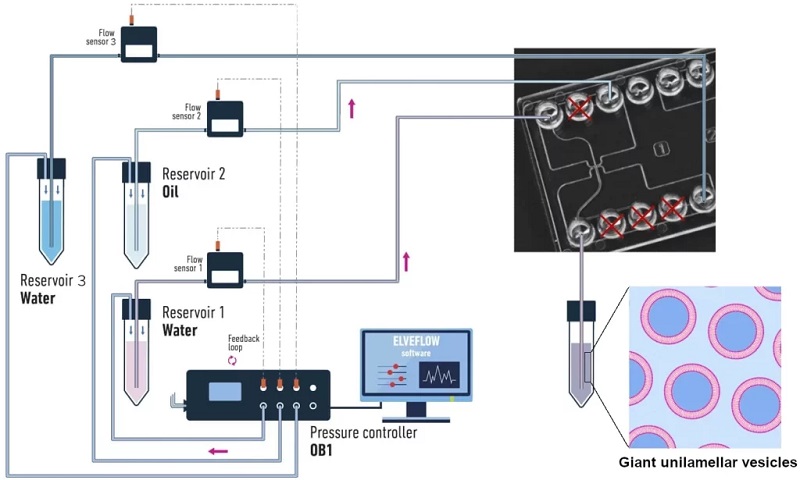
Elveflow巨型单细胞囊泡微流控合成套装包含的组件
1)三通道可编程微流体恒压泵OB1 MK3+(量程从0到2000 mabr)
2)3个液体流量传感器
3)3个样品储液池
4)接头导管配件套装一套
5)ESI图形界面操作软件
6)用户使用手册
7)微流体1032塑料芯片2个(可选)
巨型单分子囊泡的微流控制备
巨型单分子囊泡是由直径大于1μm的脂质双层膜(或脂质体)形成的胶囊,与细胞膜有很高的相似性,可作为创建人造细胞的隔间/腔室[1]。为了合成巨型单分子囊泡,提高囊泡大小的一致性、膜的均匀性、封装效率和产量,与传统的批量方法相比,微流控制备双乳液滴的方法是较好的选择。目前,已有几种方法用于在微流控芯片内制备双乳液滴的GUVs[2-5]。GUVs可用于封装蛋白质、DNA和RNA[6]。
为了模仿细胞功能,包括疾病的发展、新陈代谢和平衡,蛋白质可以被包裹进巨大的单细胞囊泡双层膜中[7]。膜的组成可以通过改变用于制备GUVs的脂质或脂质混合物的组成进行调整[8]。用这种方式制备的巨型单层膜囊泡可以稳定1个月以上[9-10]。
您也可以阅读我们基于Staufer等人的文章,使用自下而上的生物学合成细胞器的简短评论[11]。
GUVs是用天然存在的分子制成的。聚合物囊泡也可以用类似的方法制备[12]。
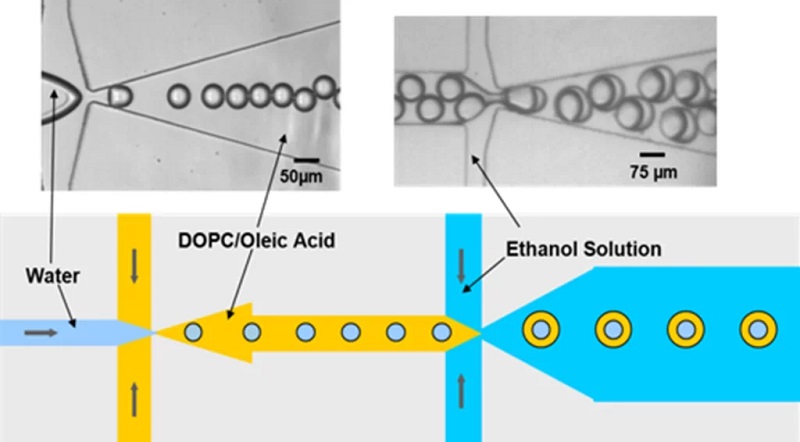
Schematic and microscope images of single and double emulsion formation. First, water droplets are sheared by the continuous phase consisting of DOPC/oleic acid which enter the junction from the top and bottom channels. [13]
[1] Sato, Y.; Takinoue, M. Creation of Artificial Cell-Like Structures Promoted by Microfluidics Technologies. Micromachines 2019, 10, 216.
[2] Petit, Julien, et al. “Vesicles-on-a-chip: A universal microfluidic platform for the assembly of liposomes and polymersomes.” The European Physical Journal E 39.6 (2016): 1-6.
[3] Deshpande, S.; Caspi, Y.; Meijering, A.E.; Dekker, C. Octanol-assisted liposome assembly on chip. Nat. Commun. 2016, 7, 10447.
[4] Arriaga, Laura R., et al. “Ultrathin shell double emulsion templated giant unilamellar vesicles with controlled microdomain formation.” small 10.5 (2014): 950-956.
[5] Van Swaay D, deMello A. 2013 Microfluidic methods for forming liposomes. Lab Chip 13, 752–767.
[6] Yu B, Lee RJ, Lee LJ. 2009 Microfluidic methods for production of liposomes. Methods Enzymol. 465, 129–141.
[7] Kamiya, K. Development of Artificial Cell Models Using Microfluidic Technology and Synthetic Biology. Micromachines 2020, 11, 559
[8] M. Komiya, M. Kato, D. Tadaki, T. Ma, H. Yamamoto, R. Tero, Y. Tozawa, M. Niwano, A. Hirano-Iwata, Chem. Rec. 2020, 20, 730.
[9] Osaki, Toshihisa, and Shoji Takeuchi. “Artificial cell membrane systems for biosensing applications.” Analytical chemistry 89.1 (2017): 216-231.
[10] Martino, Chiara, et al. “Protein expression, aggregation, and triggered release from polymersomes as artificial cell‐like structures.” Angewandte Chemie 124.26 (2012): 6522-6526.
[11] Staufer, O., Schröter, M., Platzman, I., Spatz, J. P., Bottom-Up Assembly of Functional Intracellular Synthetic Organelles by Droplet-Based Microfluidics. Small 2020, 16, 1906424.
[12] Petit, Julien, et al. “Vesicles-on-a-chip: A universal microfluidic platform for the assembly of liposomes and polymersomes.” The European Physical Journal E 39.6 (2016): 1-6.
[13] Teh, Shia-Yen, et al. “Stable, biocompatible lipid vesicle generation by solvent extraction-based droplet microfluidics.” Biomicrofluidics 5.4 (2011): 044113.
定制您的人造细胞液滴微流控套装
微流体1032液滴芯片发生器可用于制备GUV在内的双乳液滴,该芯片的材质是PC和COC。具体结构图如下图所示。
此外,Elveflow提供各种不同的样品储液池、流量传感器、气泡检测器和除泡器或其他微流体相关的仪器,以帮助您快速的搭建微流体实验平台。借助免费提供的C++、MATLAB、Python和LabVIEW库文件,可以重构新的操作界面GUI,以实现微流体实验平台的自动化控制和参数设置。
我们还提供基于细胞生物学的微流体套装如细胞大小分选套装、血脑屏障芯片套装、浓度梯度芯片套装/微流体趋化性实验套装等。








