液滴微流控由于其独特的特点,如小型化、区室化和并行化,在微生物研究中表现出了巨大的潜力。多重液滴内容允许以高度并行的方式研究各种实验条件。然而,液滴库的生成和跟踪在高通量筛选中仍然具有挑战性。将不同的试剂引入液滴中需要精确控制微流控芯片中的液滴流动,从而限制了几种试剂的吞吐量。此外,由于其快速动态,跟踪单个液滴非常复杂。为了应对这些挑战,我们开发了一个用于自动样品制备的多重平台,能够按需合并和混合试剂,以微调液滴生成的样品成分。通过将四种荧光染料在六种浓度水平下成对组合,可以实现具有 169 个光学条形码的编码空间,以根据实验设计的要求对液滴群进行编码。机器学习算法已被用来识别不同的液滴群。作为概念证明,我们对一种菌株进行了抗生素敏感性测定,以筛选四种抗生素的敏感性,并在一个实验中确定最低抑制浓度。利用按需样品制备、光学条形码和机器学习分析,我们的设置为众多微生物和生化应用提供了快速、简单且可靠的多重分析能力。
基于液滴的微流控技术在过去十年中备受关注,因为它具有几个独特的优势。利用该技术,可以每秒产生数千个高度单分散的液滴。高生成率使其成为高通量和并行实验的理想方法。液滴的体积可以从皮升至纳升,这大大降低了高通量应用中的试剂消耗和成本。此外,高表面积与体积比有助于加快反应速度。凭借这些独特的特性,基于液滴的微流控技术已经展现出在各种科学和医学领域中进行高通量筛选应用方面巨大潜力。
液滴在微生物学应用中也被广泛用于高通量筛选,包括酶活性、抗生素耐药性和药物的组合研究。对于这样的实验,通常需要或有必要研究多个实验条件。这同时带来了筛选过程中的关键优势,如时间效率、增加通量和减少实验变异。所需的条件可能是不同的分析物浓度、底物、培养基组成或缓冲液等。然而,在高通量筛选中,液滴库生成和内容跟踪仍然是关键挑战。在基于液滴的微流控平台上进行多重实验条件需要开发复杂的过程控制、流体处理和分析管道,因为这些平台占地面积较小,并且样品在其中传输速度快。
在微流控芯片中引入不同的化学成分到液滴中需要对液滴流动进行精确控制。这限制了可以处理的试剂通量,因为过程动态需要与液滴生成或再注入相匹配。快速的动态过程也使得跟踪液滴内容并使其回到实验条件下成为一项具有挑战性的任务。已经有研究针对组合筛选应用进行了相关研究。在某些方法中,在液滴生成之前进行多重样本制备步骤,然后将准备好的样本注入一个或多个微流控芯片以生成液滴。还有基于梯度的方法,通过多个进样口将不同的溶液注入微流控芯片以生成具有不同条件的液滴。然而,这些方法要么需要在液滴生成之前进行耗时的准备过程,要么需要随着试剂数量增加而增加精确流体控制单元。因此,随着为额外实验条件添加新试剂,样品制备时间和复杂性将增加,并且会限制组合处理通量、增加样本变异性、降低样本重现性(这在微生物学实验中是一个很大挑战)。
为了可靠地区分不同菌群的液滴内容,人们开发了多种编码策略。在一些光学条形码策略中,在样品制备步骤中使用特定浓度的荧光染料来对不同菌群进行编码。另一种光学条形码方法是使用彩色或荧光标记的珠粒或量子点。另一种方法是基于核酸的条形码,它将条形码与液滴内容的遗传物质联系起来。尽管这些方法可以实现大规模检测,但它们并不能完全满足需求,尤其是在微生物学中对按需组合应用的需求。此外,在基于核酸的条形码的情况下,需要进行测序,这反过来又需要破滴和复杂的分析步骤。最近,开发了一种集成微流控芯片设计,通过使用阀门控制层来实现对抗生素敏感性测试的自动化样品制备。使用该集成芯片和四种不同的药物,可以测试16种条件。然而增加更多试剂入口会增加设计复杂度,并使不同试剂之间受控合并和混合成为具有挑战性任务。此外,在该平台上追踪液滴时采用顺序方式进行操作, 这使得它们容易在芯片内受到干扰。因此,在微生物学应用方面, 该平台存在局限性, 因为无法在芯片外培养更大数量液滴。
在这项工作中,我们提出了一种用于按需多路复用样品制备的多路复用平台,以进行组合皮升滴液生成。该平台通过自动化样品插头生成直接输入到皮升滴液生成中。在滴液生成之前,最多可将8种试剂的样品插头有效地合并和混合,以产生均匀的多重混合群体。重要的是,由于只使用单个微流控芯片,因此引入了清洗插头来确保无污染的滴液生产。我们采用了光学条形码策略来编码滴液群体的内容,利用荧光染料组合可以生成高达169种潜在代码,并使用机器学习方法进行解码。为了展示该平台对微生物学应用的适用性,我们对模型菌株针对四种抗生素进行了25种不同条件下的多重抗性检测。我们展示了在单次实验运行中,在培养8小时内完成敏感抗生素鉴定并确定其最小抑菌浓度的能力。
多重化平台的搭建与运行
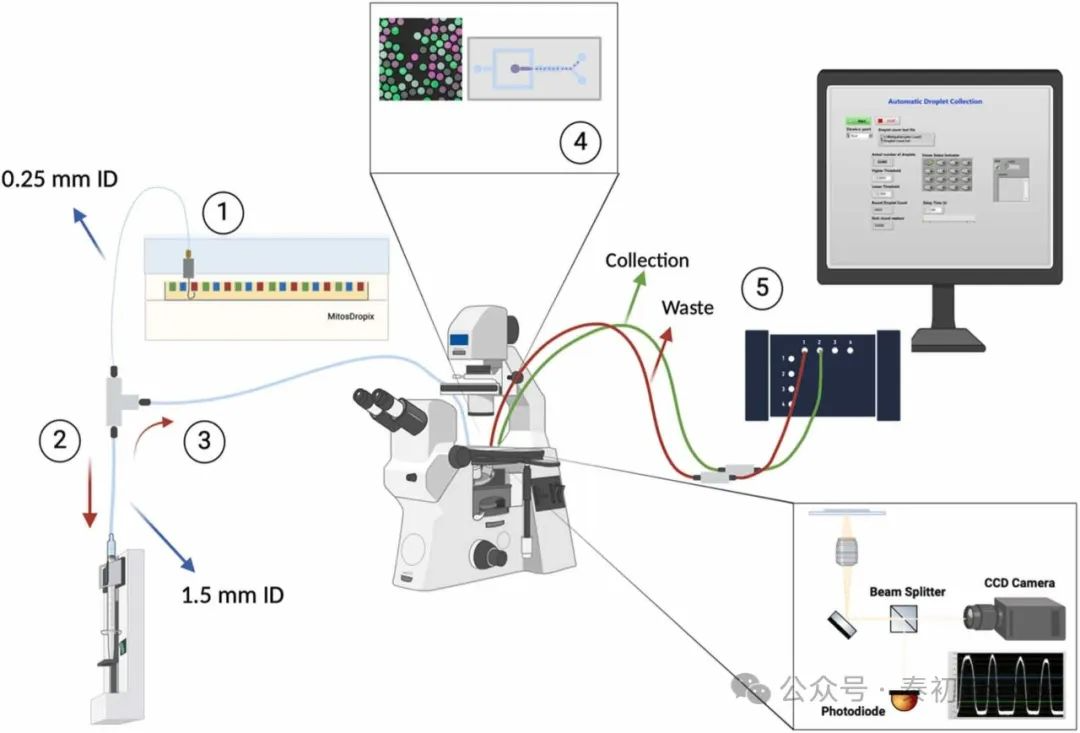
如图1所示,通过以下三个主要步骤(步骤1至步骤3)可实现对样本插头的按需自动化多重化,以生成液滴。在第一步中,我们使用商用液体处理器(Mitos-Dropix Dolomite)生产所需体积的插头。该液体处理器具有油箱、可装载多达50 μL试剂的24个样本孔条带以及连接到注射泵的样品钩。样品钩在设备控制软件定义的孔之间移动,并进入每个孔,以抽取所需的插头体积(如图1所示)。抽取的最小体积取决于工作流速和样品钩管的内径(ID)。在我们的设置中,使用了内径为0.25 mm的样品钩管。该管连接到内径为1.5 mm的管子(如图1所示),用于存储和合并插头步骤。在第二步中,将合并具有不同内容的两个或多个插头。对于具有足够接近油间距的两个插头,从窄管配置过渡到宽管配置将导致合并。这是在带有扩展室的微流控芯片中出现的一种已知现象。我们使用三通阀将两个具有不同内径(0.25毫米和1.5毫米)的管子连接到平台上,如图1所示。我们基于最小油间隙和从小内径管子过渡到较大内径管子时可以合并的插头数量,优化平台以在15和100 μLmin-1的流速下运行。我们观察到,对于较高的流速,油间隙较大,适合合并插头。为了解决这个问题,在100 μLmin-1的实验中,通过化学修饰TWEEN20来改变溶液,以减小插头在管子中流动时之间的距离。在100 μLmin-1的流速下,最多可以合并三个插头,而在15 μLmin-1的流速下,最多可以合并8个插头。有关流速选择和样品制备的更多详细信息,请参见图S1和补充信息1 引言、2 材料和方法。同样,将1.5毫米的管子长度调整为组装、混合和存储至少7个最终样品插头,以进行最多14个条件的多重实验。
图1. 多重扩增平台工作流程。步骤1:将各种试剂加载到条带上的孔中,商业设备被编程从每个孔中吸取特定体积的试剂。步骤2:样本合并与储存:从窄管(内径为0.25毫米)过渡到宽管(内径为1.5毫米)可实现样本的合并,并将它们储存在同一管中。步骤3:通过振荡流动混合:一个三通阀连接1.5毫米的管段,一个注射泵被编程以产生振荡流动。步骤4:生成液滴:将样本塞注入微流体芯片以生成液滴。步骤5:为了避免收集由洗塞产生的液滴,芯片出口将自动切换以确保只收集所需的液滴。
在第三步中,合并的塑料塞被混合以获得最终样品塞内均匀的混合物,从而形成均匀的液滴群。通过将三通阀切换连接两个1.5毫米管段,并利用编程注射泵产生振荡分段流(图2a)来实现混合。在这种方法中,在液体塞内形成了两个轴对称的循环区,以增强溶质分子的混合。我们通过分析随后生成的液滴群平均强度变化来研究10微升塑料塞(磷酸盐缓冲液(PBS)和6-羧基荧光素不同比例的合并塑料塞)的混合效率。每种浓度都进行了四次重复实验。我们使用1000个500毫秒循环以1000 μL/min流速对样品进行混合。塑料塞体积影响着其长度和所需混合循环次数:体积越小,混合过程越快。此外,试剂性质如密度、粘度和亲水性也在定义所需混合循环次数方面起着重要作用。图2b展示了利用优化芯片设计生成10微升样品插头所得到的液滴群强度直方图。绿色荧光强度平均变化低于10%,表明在定义好的参数下,在10微升插头内实现了高效混合。完成混合后,样本可用于产生液滴(见图1步骤4;图2c-d)。
图 2. (a) 导管内混合过程示意图。通过编程注射泵产生的脉动流促进了混合。(b) 由混合塞产生的四种不同液滴群的绿色荧光强度的平均变异系数为6.15%,表明混合有效(n=5223)。(c) 来自2 μL样本的液滴的明场图像(标尺=50 μm)。(d) 由优化芯片产生的液滴直径分布,表明产生了单分散群(CV=4.98%,n=562)。
交叉污染的预防和自动液滴收集
在我们的平台中,我们使用单个微流控芯片从多种条件下生成液滴。在通道传输过程中,前一个样本可能会留下试剂残留物,这可能会污染后续样本。因此,必须避免和最小化交叉污染,因为它可能导致不准确的分析结果。为了调查我们平台的交叉污染可能性,我们生成了由红色和绿色荧光染料标记的PBS样品塞组成的两成员液滴库。在散点图中可以看到一些具有中间强度的液滴显示出来自其他染料的污染(见图3a)。在第二项实验中,我们引入了纯PBS清洗塞以清洁微流控芯片之间的样品。这些清洗塞显著减少了交叉污染(见图3b)。然而,在清洗芯片时也会产生一些不需要的液滴。为了避免这些情况发生,我们开发了一个自动液滴收集装置(如图1中步骤5所示)。
图3. (a) 微流控芯片连续生成的两个液滴群的散点图(n=3104)。前一个样本的残留污染会影响后续液滴的生成,导致两种荧光染料的交叉污染。(b) 在每个样本之间插入清洗插头可以减少交叉污染,但中间液滴(云3)仍然会被收集(n=1757)。(c) 使用自动化液滴收集装置收集的两滴液滴库的荧光和明场图像叠加图。(d) 使用自动化液滴收集区域收集的液滴散点图,准确地消除了中间液滴的收集(准确率99.96%,n=2415)。
在液滴生成过程中,该设置利用观察显微镜上的光学计数器,并结合电磁阀(Multiplexer流量矩阵阀, Elveflow)控制微流控芯片的出口。使用这一设置,定制编写的LabVIEW软件根据三个参数在收集和废弃出口之间进行切换:主样本之间的时间间隔、下限和上限计数阈值。工作流速定义了时间间隔。上下限计数阈值确定最初要忽略的液滴数量以及要收集的液滴数量,并且取决于样本体积和每个液滴群的目标大小。