液滴微流控技术已经成为一种快速、精确、定量和低成本的生物和化学筛选工具。液滴微流控器件产生的单分散油包水液滴装载了生物或化学制剂。液滴被用作微室或反应腔室。为了分析和/或分类液滴的内容,通常要添加染料。然后根据它们的荧光信号对液滴进行监测和分类。
在涉及染料使用的液滴微流控实验中,一个常见的问题是染料泄漏。染料释放到油相和邻近的液滴中,导致荧光监测的准确性下降。影响染料在微滴中保留的一些参数有:缓冲液或细胞培养基的性质、荧光团的选择及其亲水性、油相和表面活性剂的浓度、性质和分子量。
在本研究中,我们全面研究了氟油的选择和表面活性剂的浓度对微流控实验中染料泄漏的影响。讨论了两种氟油和表面活性剂浓度对染料保留率的影响。
I)材料和方法
1. 氟油的性质
在这项研究中,我们选择了两种氟油:Fluo-Oil 40和Fluo-Oil 200来研究基于微流控实验的染料泄漏。这两种氟化油的配方都确保了微流体实验的稳定性、生物相容性和可重复性,作为Fluorinert FC40氟油的替代品。
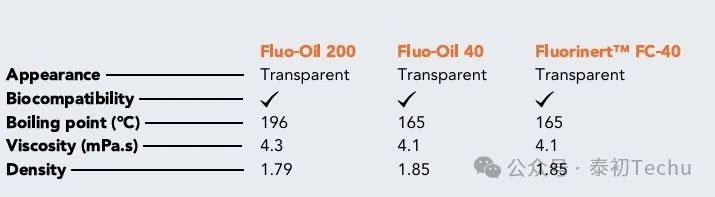
Table 1:Fluo-Oil 200, Fluo-Oil 40和Fluorinert FC-40物理性能
Table 1 给出了两种氟化油的物理性质。将两种氟化油的性能与Fluorinert FC-40的性能进行了比较。Fluorinert FC-40的性能与Fluo-Oil 40相同。Fluo-Oil 200的密度略低于Fluo-Oil 40和Fluorinert FC-40的密度,而其沸点和粘度略高。在形成液滴微球的过程中,可能需要稍加调整液体的流速才能获得相似的液滴,但两种油的物理性质仍然非常接近。
2. 微流控实验
为了评估氟油的选择对染料泄漏的影响,使用两种油产生油包水液滴微球。评估液滴大小分布、37°C孵育后的稳定性以及分子保留率。
用于产生液滴微球的PDMS/玻璃微流控芯片由流动聚焦几何结构组成。微通道经过疏水试剂Fluo-ST2(疏水表面处理)处理。在比较两种氟油的研究中,通过在Fluo-Oil 200或Fluo-Oil 40中溶解4w/w%的纯FluoSurf?-C表面活性剂来制备油连续相。这些实验使用的分散水相为PBS, 20μM荧光素PBS, 2μM再间萘酚PBS或44μM resazurin + 40 mM半胱氨酸PBS。通过分析空液滴和含有荧光染料的液滴的混合物,对两种氟油进行了比较。采用注射泵控制微流控液滴芯片中不同相的流速(油相:300μL/h,水相:100μL/h)进行液滴稳定性实验;油相:600μL/h,水相:100μL/h进行染料保留实验)。
用倒置显微镜监测液滴的生成。使用Image J 软件进行图像分析。
II)孵育后液滴稳定性
在两种氟油(Fluo-Oil 40和Fluo-Oil 200)中通过孵育研究了液滴的稳定性。在37°C孵育3天前后分析液滴的大小分布。
结果如图1所示。
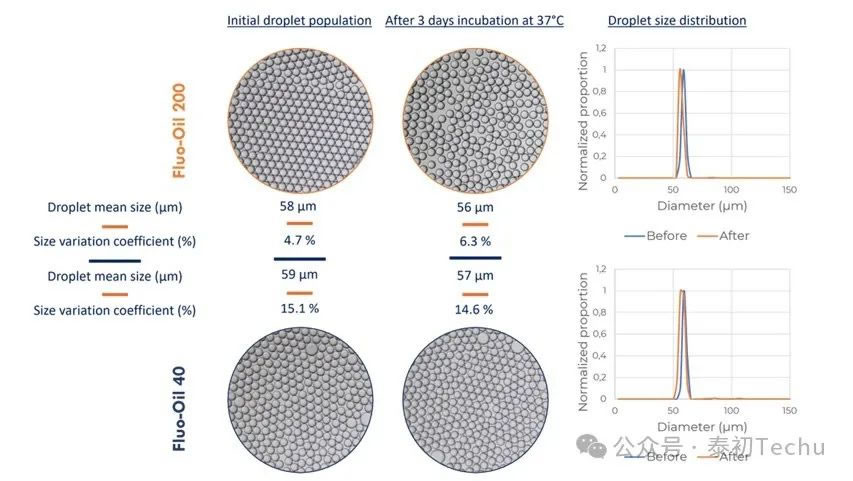
图1: Fluo-Oil 200和Fluo-Oil 40在37℃孵育3天前后的油包水液滴大小分布及相关照片。
两种油的平均液滴直径约为60μm。对图像的统计分析显示,FluoSurf?C稳定液滴在Fluo-Oil 40和Fluo-Oil 200中产生的尺寸变化系数(CV)分别为15.1%和4.7%。经孵育后,Fluo-Oil 40和Fluo-Oil 200的液滴大小相似,大小变异系数(CV)分别为14.6%和6.3%。在Fluo-Oil 200中生成的液滴在孵育前后的尺寸变异系数(CV)较低,这意味着在Fluo-Oil 200中生成的液滴比在Fluo-Oil 40中生成的液滴分散得更少。每种油在孵育前后的两个系数之差很低,在整个孵育过程中所产生的液滴的稳定性是恒定的。
综上所述,Fluo-Oil 200氟油在产生的液滴分散性方面优于Fluo-Oil 40。然而,两种油产生的液滴在整个孵育过程中表现出优异的稳定性。
III)染料保留(Dye retention)
本部分研究了两种油(Fluo-Oil 40和Fluo-Oil 200)在培养过程中染料在液滴中的保留情况。选择两种染料:荧光素和再间酚。
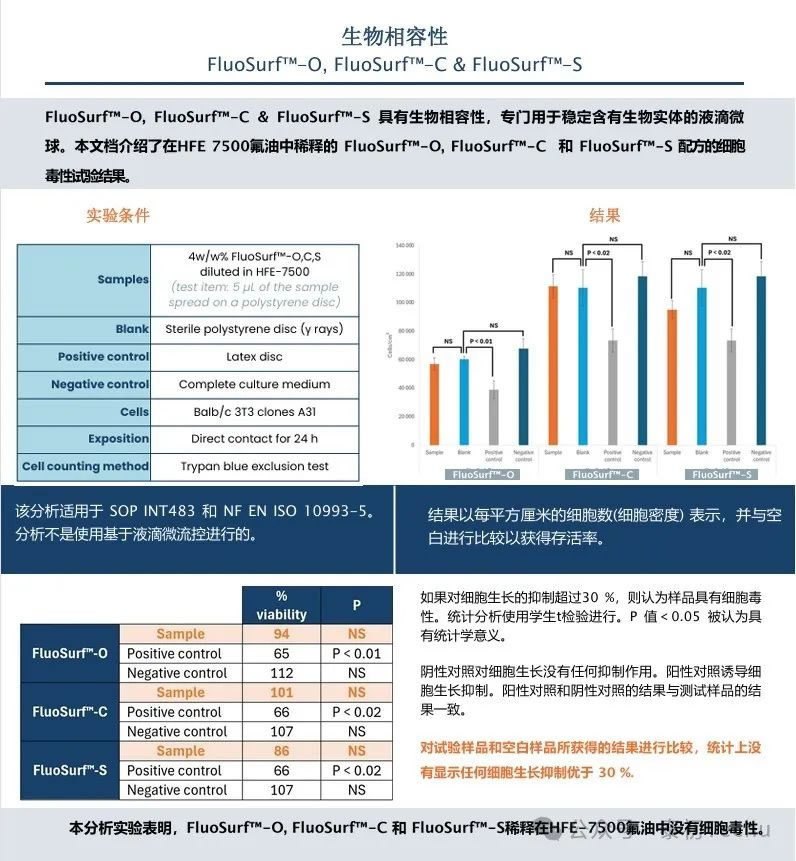
1. 荧光素作为模型化合物
荧光素作为一种荧光染料在微流控实验中被广泛使用,本研究将荧光素作为一种模型化合物进行保留( retention)研究。
在Fluo-Oil 40和Fluo-Oil 200氟油中交替生成两种油包水液滴微球乳化剂[“空”(负载PBS)和“满”(负载PBS的20 μM荧光素)液滴]。含有两种液滴(“空”和“满”)的混合物在37°C下孵育,并在不同的时间点拍摄照片。对满滴和空滴的荧光强度演变进行统计定量分析的图片和结果见图2。
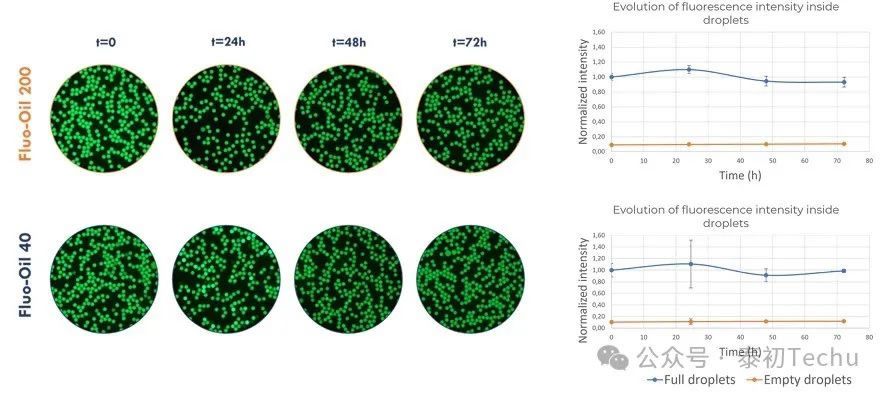
图2: Fluo-Oil 200和Fluo-Oil 40中油包水滴在37°C孵育过程中,满滴和空滴混合的图片以及平均荧光强度的演变。
在图2所示的图片中,黑色液滴对应于空液滴,绿色液滴对应于含有荧光染料荧光素的液滴。在这两种油中,在t=0,即产生后和在t=72h,即孵育结束时,没有观察到满滴和空滴之间的串扰。荧光素在这两种油中的染料保留率都很好。在满滴和空滴的平均荧光强度的评估证实了这些结果,显示两种油的几乎恒定值。
综上所述,荧光素染料保留在Fluo-Oil 200和Fluo-Oil 40中产生的液滴中非常有效。
2. 再溶素:微生物学中常见的细胞活力标记物
在微生物学中,间苯二酚常被用作检测细胞活力的探针。在基于间苯二酚的检测中,低荧光强度的分子通过细胞代谢转化为高荧光的间苯二酚。reazurin就是这样一种分子。Resazurin呈蓝色,荧光弱,但在与活细胞接触时,它通过氧化还原反应还原为间苯二酚,一种红色的高荧光化合物,如图3所示。
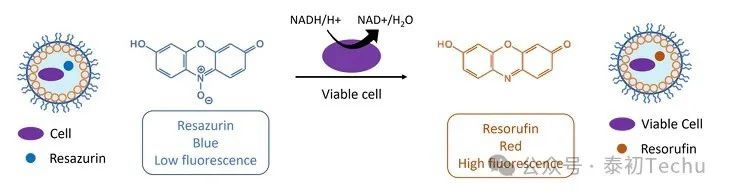
图3:方案说明如何使用间苯二酚作为荧光探针来测试细胞活力。
这种微生物学试验已经应用于基于微流控的液滴微流控领域中:一个细胞被一个用瑞祖林(resazurin)包裹在一个微滴中;如果液滴变成荧光,则荧光液滴中包含的细胞是有活力的。例如,这种试验适用于食品中病原体的快速检测。
第一部分,在两种不同的氟油中,表征了再间酚在液滴中的保留。在评价了最适合的油后,对表面活性剂的浓度进行了优化。一旦确定了最佳条件,在培养过程中表征了瑞祖啉(resazurin)在液滴内的保留和转化为再间萘酚(含半胱氨酸)。
● 油的选择对resorufin滞留的影响
首先,表征了在液滴中的荧光化合物间苯二酚的保留。如前所述,两种油包水液滴乳液微球[“空”(负载PBS)和“满”(负载PBS的2 μM再间苯二酚)液滴]在Fluo-Oil 40和Fluo-Oil 200中交替生成,其中含有4w/w的FluoSurf?-C。含有两种液滴(“空”和“满”)的混合物在室温下孵育,并在不同的时间点拍摄照片。
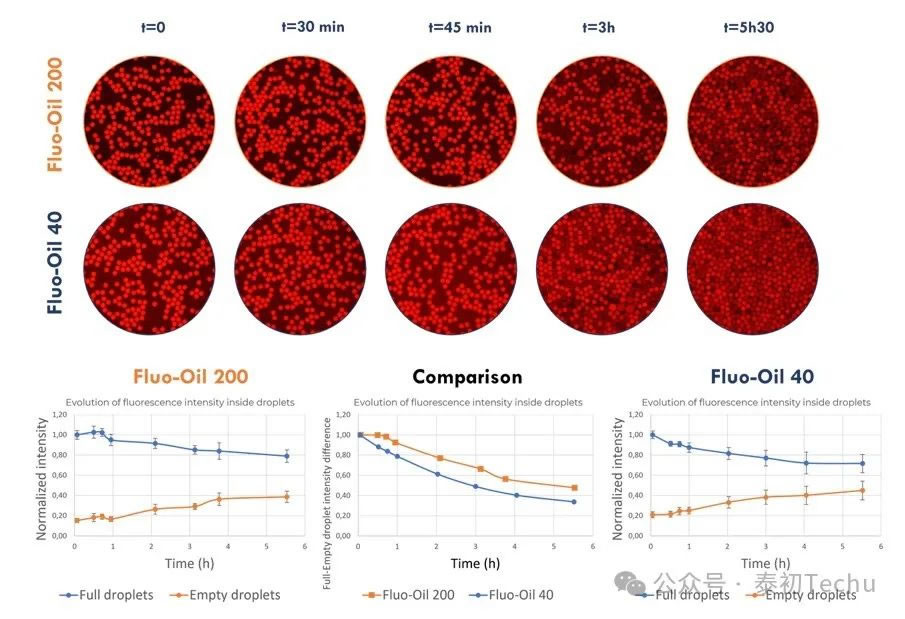
图4: Fluo-Oil 200和Fluo-Oil 40中油包水液滴室温孵育过程中,满滴和空滴混合及平均荧光强度演变图。
在图4中,对Fluo-Oil 200中产生的空滴和满滴的荧光演变进行定性和定量评价显示,在孵育45分钟后,间苯二酚开始泄漏。然而,对于Fluo-Oil 40中产生的液滴,再溶解泄漏开始于t=0。因此,在Fluo-Oil 200中观察到更好的resorufin滞留。
另一种限制微流控实验中染料泄漏的方法是调节表面活性剂的浓度。
● 表面活性剂浓度对间苯二酚(resorufin)保留率的影响
在含有三种不同表面活性剂浓度的Fluo-Oil 200中交替生成两种油包水乳液[“空”(负载PBS)和“满”(负载PBS的2 μM间苯二酚)液滴]。含有两种液滴(“空”和“满”)的混合物在室温下孵育,并在不同的时间点拍摄照片。
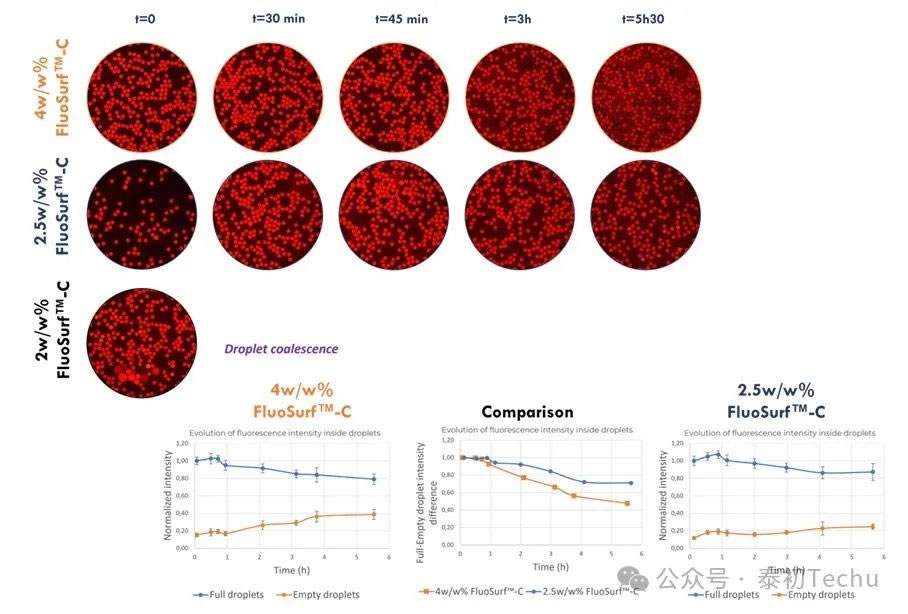
图5:在Fluo-Oil 200中使用4w/w%、2.5w/w%和2w/w% FluoSurf?-C生成的油包水液滴微球在室温下的混合和平均荧光强度演变图。
如前所述,45分钟后,在4w/w% FluoSurf?-C的Fluo-Oil 200中,resorufin开始从满滴泄漏到空滴中。在Fluo-Oil 200中加入2w/w% FluoSurf?-C,液滴在t=0时凝聚融合。2w/w%的浓度不足以保证生成的液滴的稳定性。在Fluo-Oil 200中使用2.5w/w% FluoSurf?-C,resorufin再间酚在液滴中保留的时间更长,泄漏是有限的。
因此,在我们的研究条件下,稳定液滴并尽可能限制染料泄漏的最佳浓度是2.5w/w% FluoSurf?-C in Fluo-Oil 200。
● Fluo-Oil 200油生成的液滴中基于瑞沙脲的细胞活力模型(Resazurin-based cell viability model)测定
在这一部分中,使用resazurin在液滴中进行了模型活力测定。使用前几节中找到的最佳实验条件(2.5w/w% FluoSurf?-C in Fluo Oil 200)。半胱氨酸(Cysteine),一种能够模拟活细胞活性的化合物,也被用于实验测定。PBS中含有 resazurin(44μM)的液滴和PBS中含有 resazurin(44μM)和半胱氨酸(40 mM)的液滴交替产生。液滴在室温下孵育4小时。实验方案如图6所示。
在实验开始时,仅含有resazurin的液滴是无荧光的;在孵育期间,没有串扰,液滴应保持无荧光。另一方面,在实验开始时,含有resazurin和cysteine的液滴是无荧光的;在孵育过程中,半胱氨酸将再蓝蛋白转化为再绿蛋白,液滴变成荧光。实验结果如图6所示。
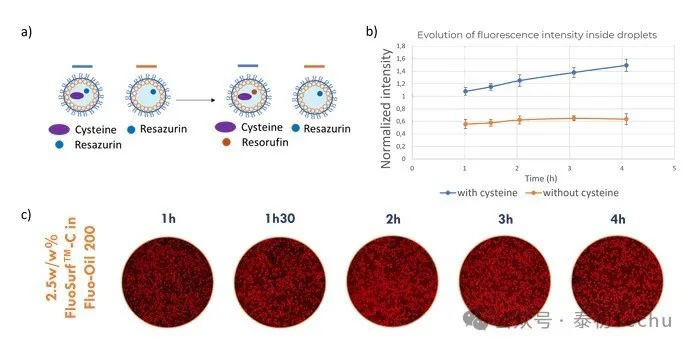
图6。a)实验方案:reazurin仅在含有半胱氨酸的液滴中转化为再间萘酚。b)在Fluo-Oil 200中含半胱氨酸和不含半胱氨酸产生的油包水液滴孵育过程中平均荧光强度的演变。c)在整个孵育过程中,满滴和空滴混合的照片。
在图6中,孵育1小时后,两个液滴群体(含cysteine的液滴和不含cysteine的液滴)的荧光差异非常小。在孵育过程中,含有cysteine的液滴的荧光水平增加,因为后者将resazurin转化为resorufin。荧光强度的表征证实了这一结果。在图中,液滴含有cysteine显示荧光强度不断增加。不含cysteine的微滴在4小时内荧光强度不变。结果表明,在4小时内,液滴之间没有串扰。细胞活力实验建议孵育时间为1-4小时。在此,我们已经证明,通过使用Fluo-Oil 200油在最佳条件下产生液滴,可以使用基于液滴的微流体进行基于resazurin的细胞活力测定。
结论
为了提高微流控实验中染料的保留率,需要对实验条件进行优化。这包括优化表面活性剂的浓度,也包括氟油的选择。
在本研究中,我们发现在微流控实验中使用Fluo-Oil 200产生的液滴微球可以显著减少染料泄漏。因此,在最佳实验条件下,使用Fluo-Oil 200氟油可以在基于液滴的微流控中实现使用resorufin间苯二酚进行细胞活力测定。
补充信息:
FluoSurf Neat表面活性剂的生物相容性和分析证书,可帮助您有效了解产品特点和多个产品之间的一致性以及适用于生物学应用的生物兼容性,确保您放心的重复使用和反复购买。