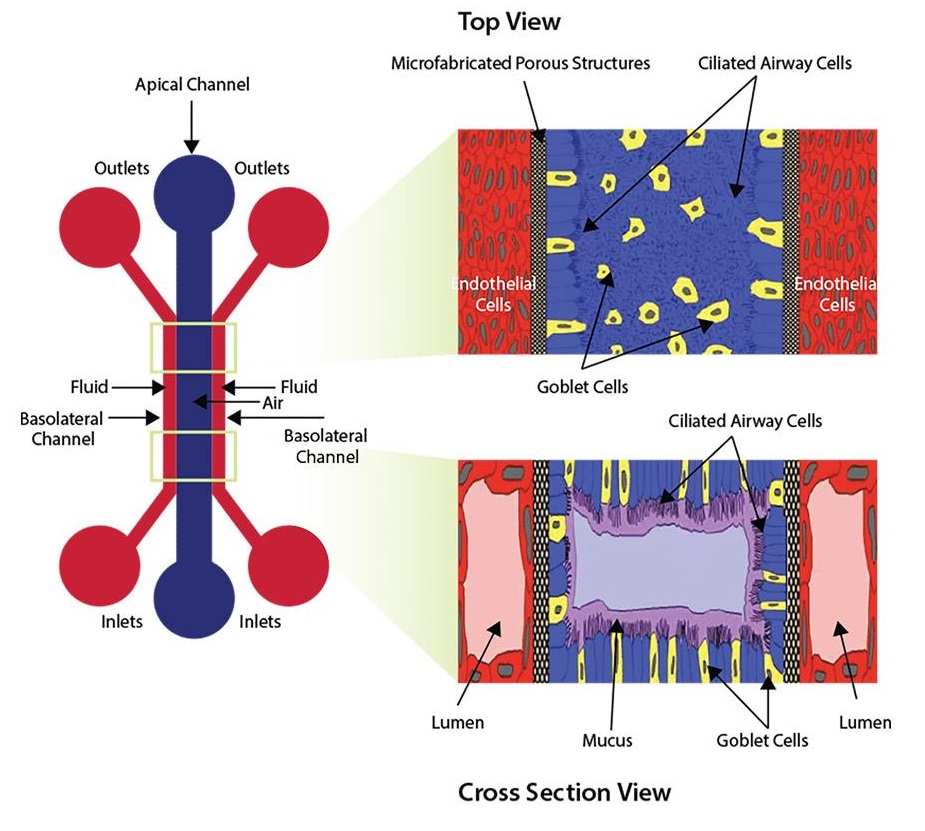
这种带有中央腔室和侧翼微通道的器官芯片可以创建模仿肺部结构的气液界面模型。被内皮细胞制成的脉管围绕的肺上皮细胞功能化的微流控芯片,可以重现典型的体内气液界面。
SynVivo的SynALI是一种新的气液界面模型(气液界面微加工的多孔结构纤毛气道细胞 - ALI),模仿了肺部的结构。该微流控芯片是光学透明的,被上皮细胞功能化,该上皮细胞被由内皮细胞组成的血管系统围绕。这种结构保持了通过气道细胞的空气流体(ALI),从而形成了运输粘液的呼吸管:这是粘膜纤毛清除的现象。
借助这种完全创新的微流控芯片,您可以实时观察和量化许多参数,例如细胞的形态,气道的结构,细胞之间的相互作用以及气道的不同功能(黏液运输,ciliary beating)和治疗改善。
● 现实的气道结构和环境
● 体内血液动力学切应力
● 实时可视化细胞和屏障功能,包括黏液,ciliary beating,免疫细胞相互作用和治疗性筛选。
● 稳健易用的协议
要进行SynALI实验,有两种套装规格可用(套装不包括建立气液界面所需的驱动泵):
起始套装
● 10个SynALI芯片-IMN2线性(3μm狭缝)
● 配件包含导管,夹具,针头和注射器
● 气动启动装置(用于导管以去除空气)
实验套装
● 10个SynALI芯片-IMN2线性(3μm狭缝)
● 配件包含导管,夹具,针头和注射器
如果您只想用芯片的话,可以单独订购芯片。
规格参数
IMN2线性芯片
● 外通道宽度:200μm
● 中央通道宽度:500μm
● 深度:100μm
● 形程宽度:50μm
● 孔径:3μm
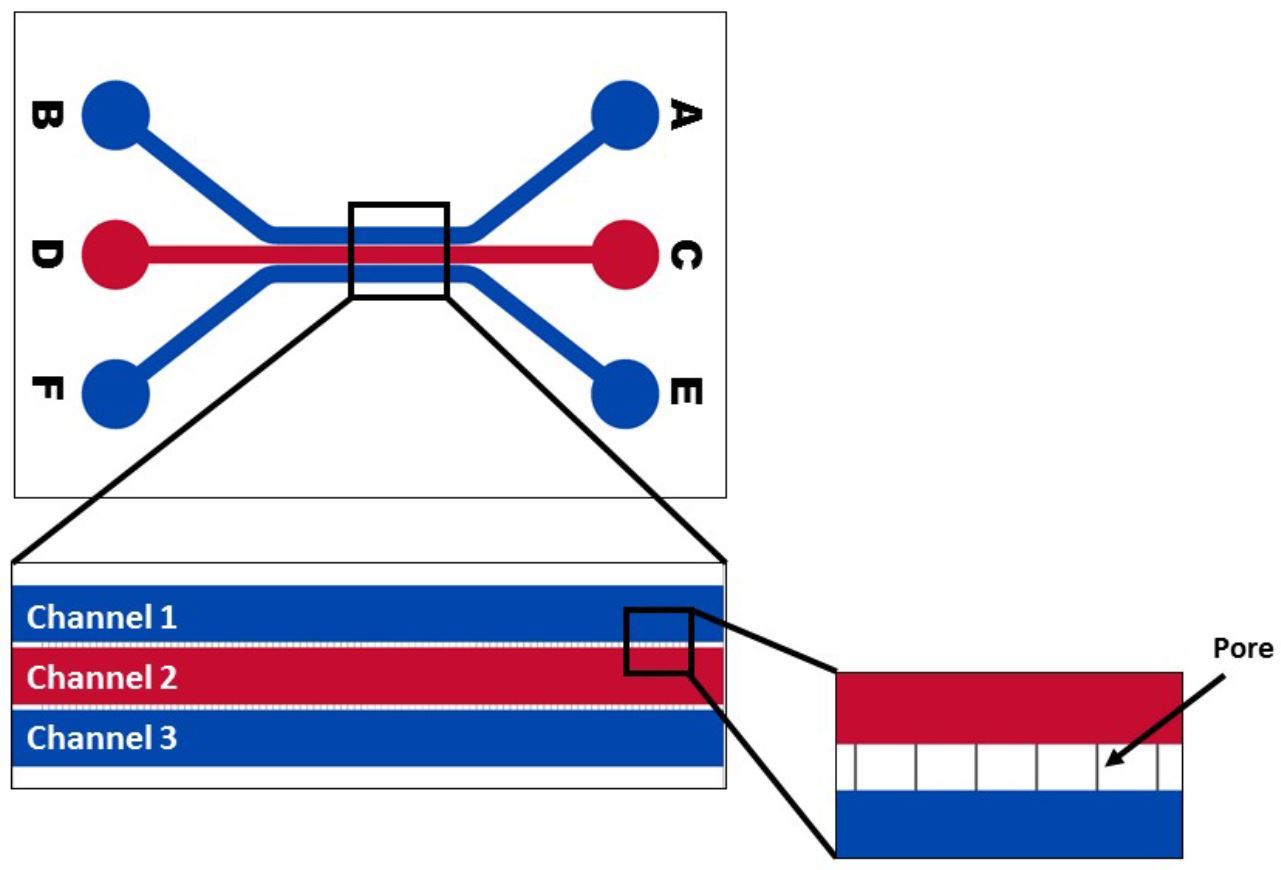
应用
气道模型可以通过内皮和上皮细胞的共培养来创建,肺泡三培养模型可以同时使用内皮、上皮和成纤维细胞。
提供气液界面模型技术手册,请联系我们索要。
已经开发出来的这些共培养协议可建立与3D肺组织连通的真正的血管单层。在这些器件中生长的人类细胞保留了与真实组织中相似的生物学表型。领先的研究人员已经证实,与使用常规培养技术培养的细胞相比,这些芯片中生长的细胞能更准确地反应体内发现的细胞行为。
与在静态条件下进行的孔板测试不同,这些芯片可再现用于评估细胞-药物和细胞-细胞相互作用的现实动态条件,从而为研究和阐明成功与失败的机制提供准确的体外平台。与体内动物研究相比,它们可以在受控环境中进行实验的实时可视化和分析。

外通道之一中的融合内皮细胞播种密度的示例

播种后立即具有肺上皮细胞的微流控器件的示例
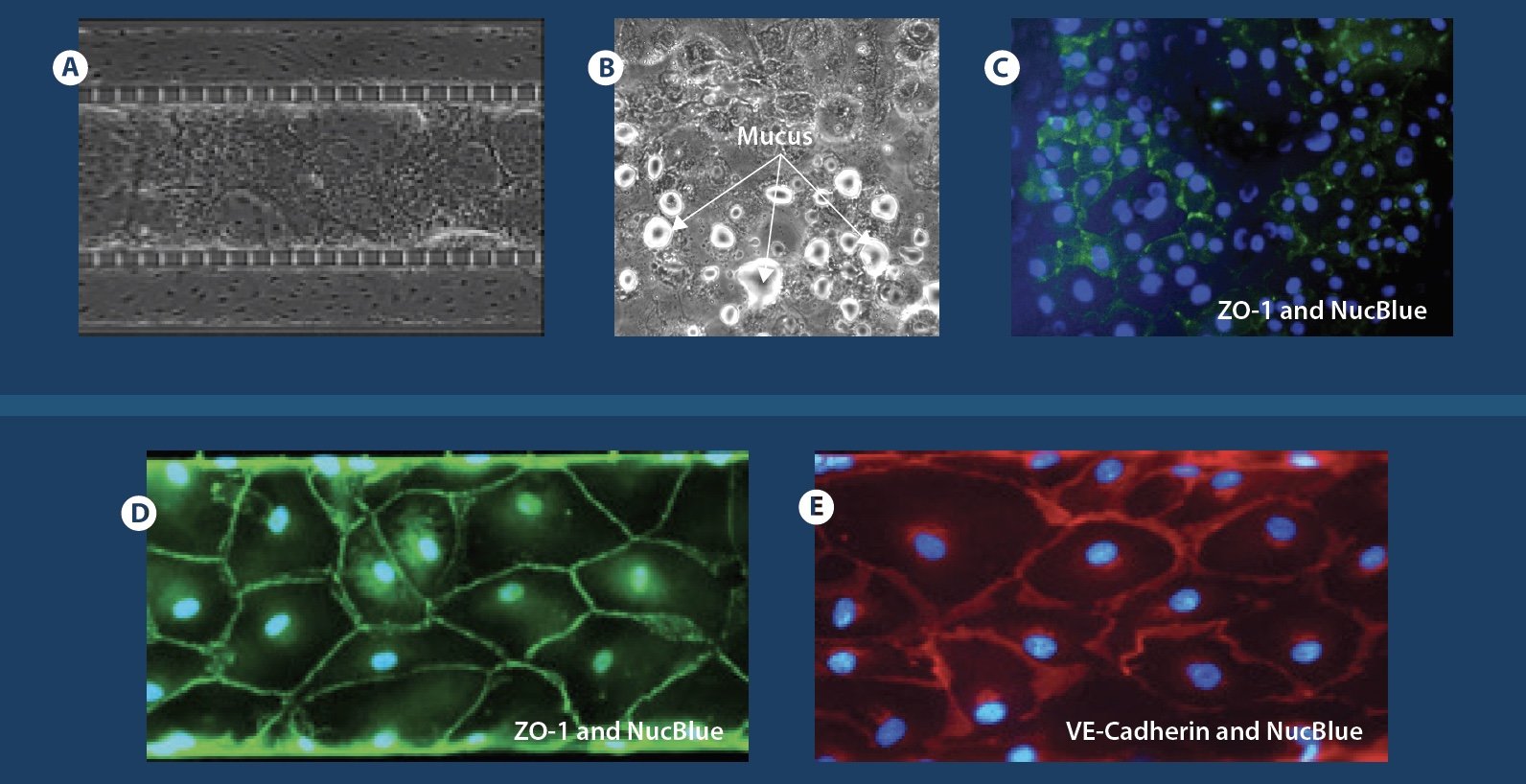
Mucus formation and biomarker staining: A) - C) Confluent co-culture of endothelial and epithelial cells; mucus formation and staining of biomarkers in epithelial cells. D) and E) Biomarker staining for tight junction markers (VE-Cadherin and ZO-1) in endothelial cells.
出版文献
Liu Z. et al., Co-cultured microfluidic model of the airway optimized for microscopy and micro-optical coherence tomography imaging, Biomedical Optics Express 2019 (Download)
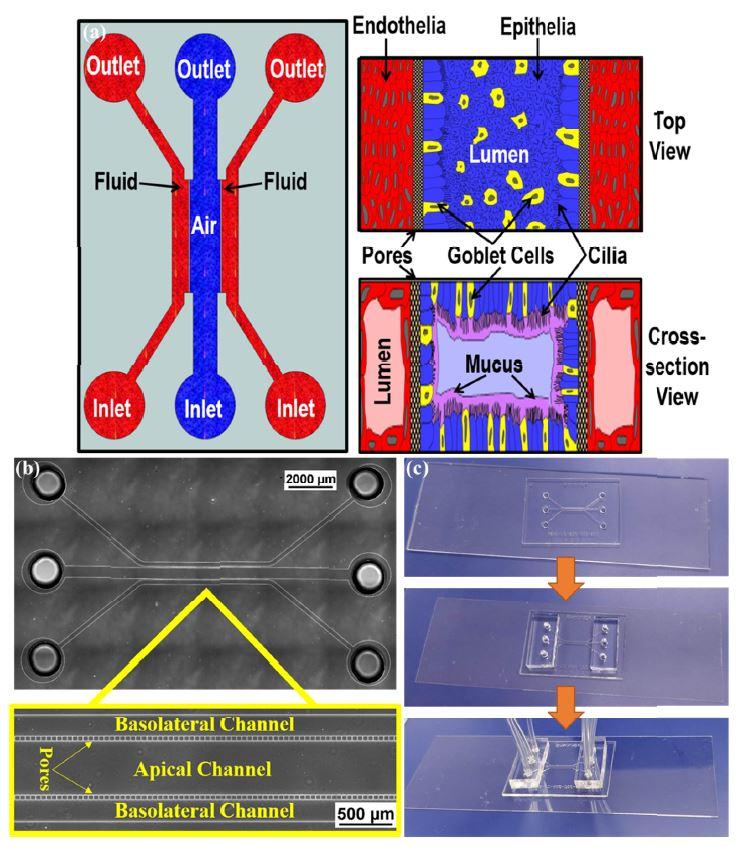
(a) The ALI device to develop the air-liquid interface across the cells. The air (or epithelial) channel is separated from two fluid (basolateral) channels by pores. Right panel shows conceptual drawing of the proposed orientation of the cells when seen from top (above) and a cross-section (below). (b) Bright Field image of the fabricated device without cells and the magnified view showing the pores. (c) Fabricated device bonded to the glass coverslip with inserted tubing for perfusion.
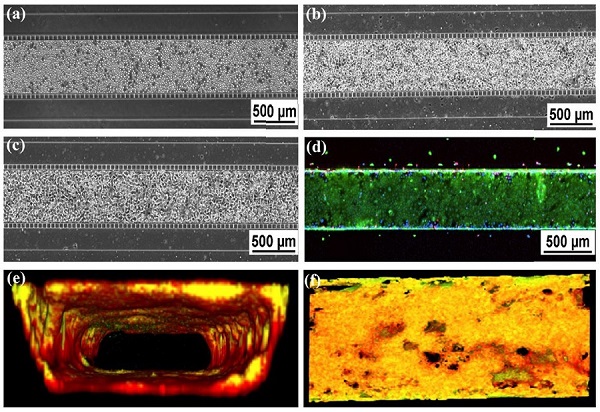
(a-c). Phase contrast imaging of HBE cells in the center channel: (a) Directly after seeding, (b) attachment of cells after 24 hours, and (c) 100% confluence after 7 days of culture. (d) Live/dead staining. (e) Cross-sectional view of 3-D reconstructed confocal image (10X mag.). Cell culture is co-stained with Plasma Membrane Orange and Calcein Green. (f). En face of Fig. 3(e).







