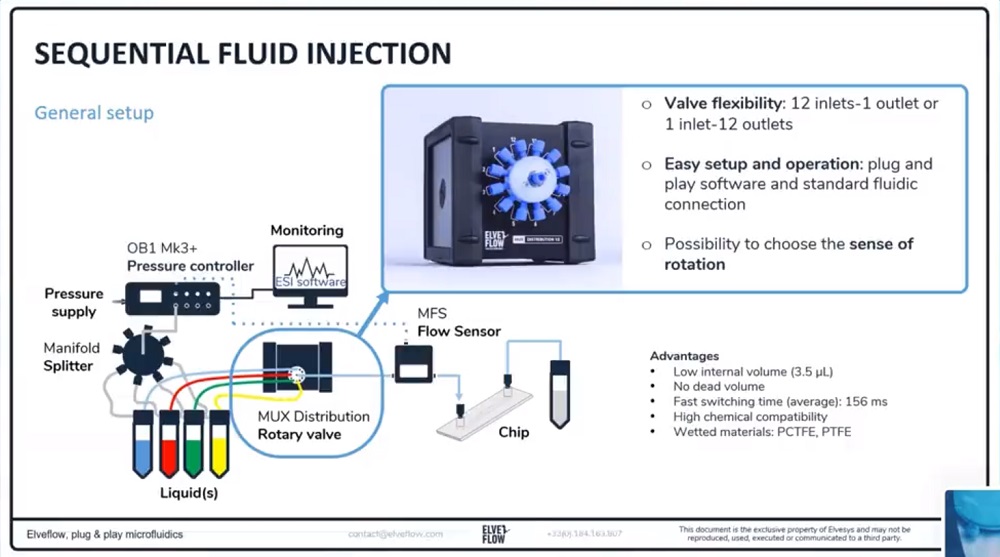
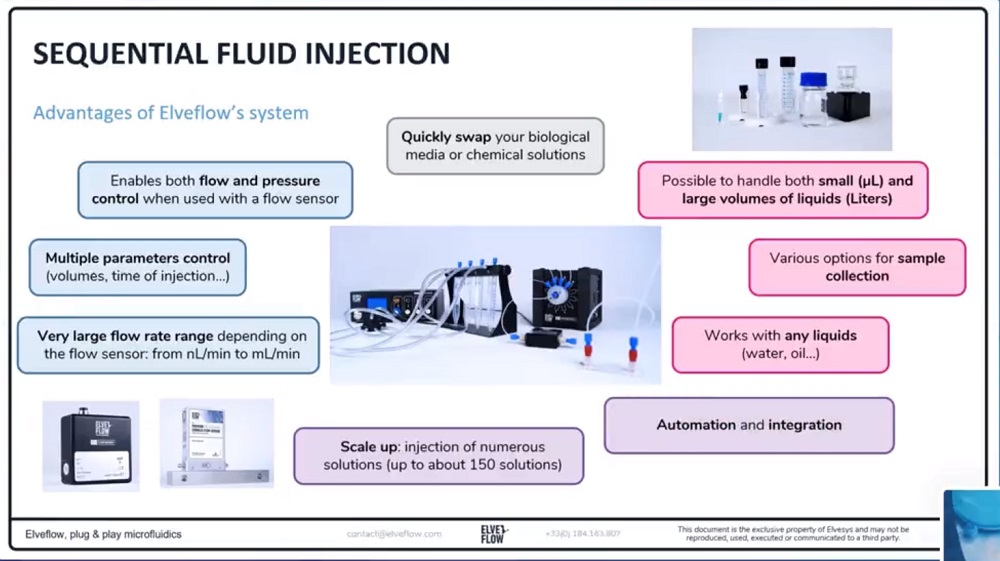
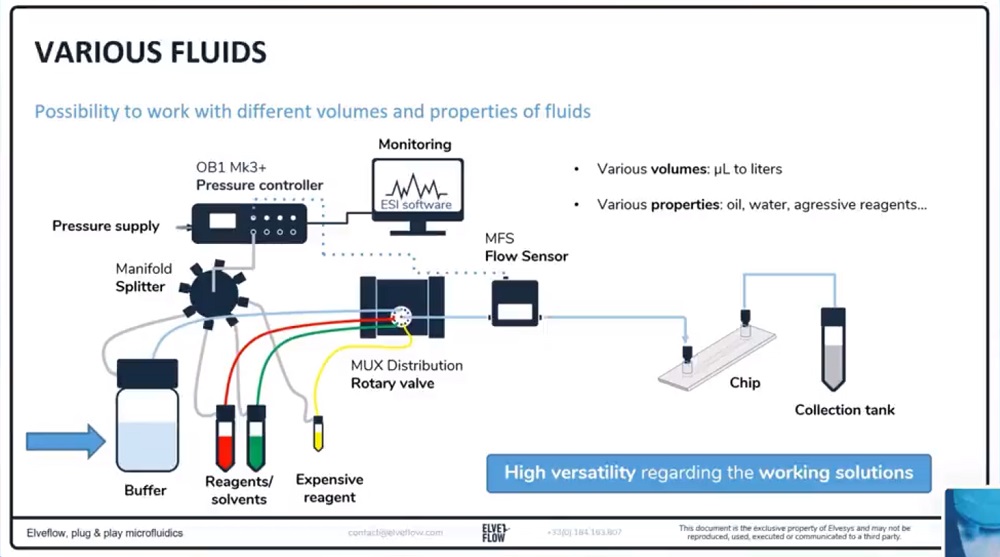
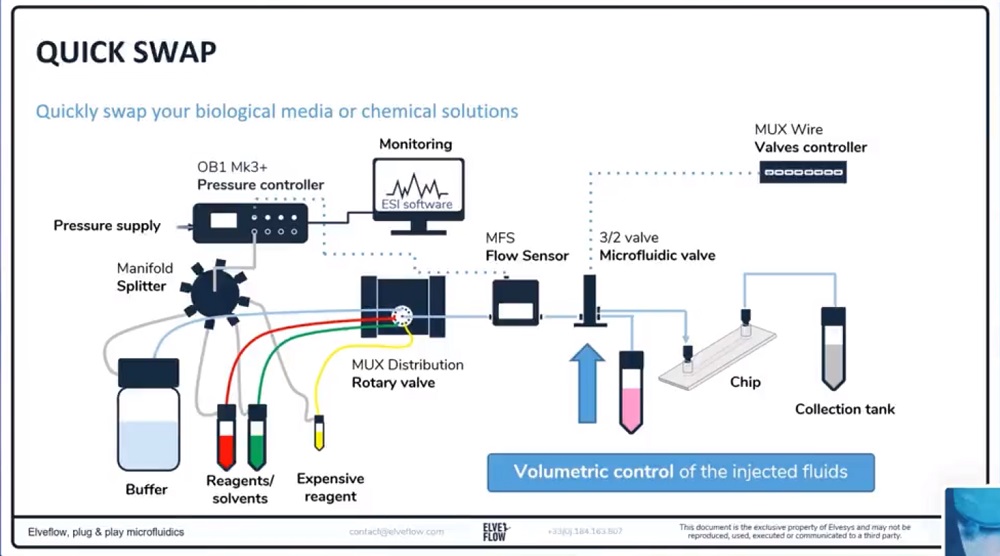
(1)多种液体介质灌注
进行稳定的液体介质灌注并在几种溶液之间切换
(2)受控剪切应力
通过各种流量控制剪切应力
(3)微流体工作流程自动化
不再是耗时的实验
(4)方便易用
多合一套装——包含所有的组件&软件
Elveflow提供了专门的细胞灌注套装,可用于细胞培养、芯片实验室、流动细胞和灌注腔室等。该套装包含所有必要的组件,以产生连续的流量并监控施加在细胞上的流速。
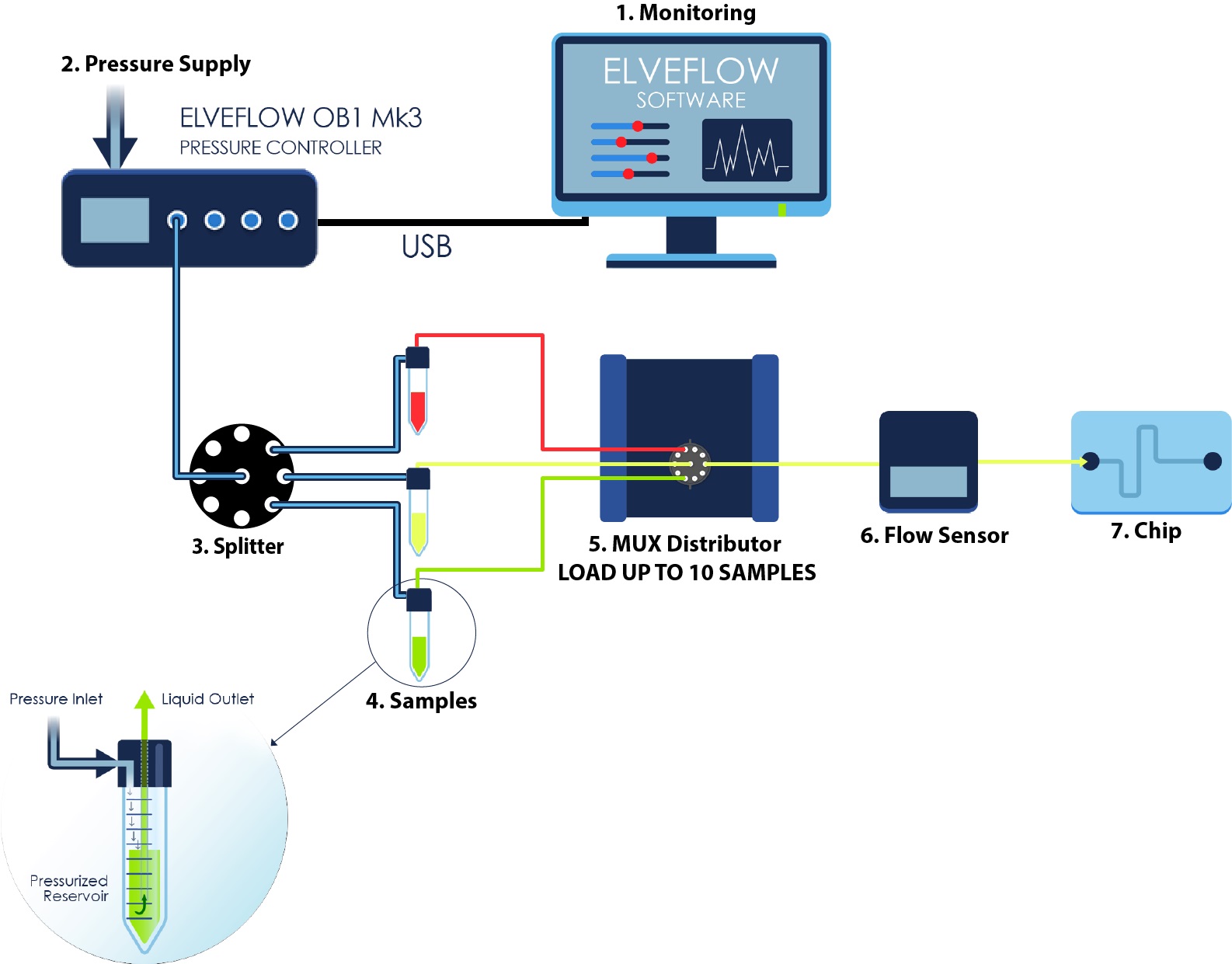
活细胞灌注套装适用于需要在不同培养介质或药物之间切换的实验。计算机控制的阀门可实现顺序进样(高达10种不同的介质或试剂)。
直观的图形操作软件ESI可快速自动的执行复杂的实验工作流程。

特点和优势
(1)同时控制压力和流量:剪切应力实验的理想选择
(2)不同介质或药物之间的快速切换:用于成像细胞对各种介质或药物的反应
(3)稳定且无脉动的流速:没有盖玻片膨胀和细胞应力
(4)流量范围大:从10 nL/min到5 mL/min
(5)设计流量注入顺序:创建复杂的流量模式例如振荡流动以模仿生理状况
(6)循环回路:适用于长时间的分析
(7)瞬时停止流动:用于受控溶液的暴露实验例如钙成像
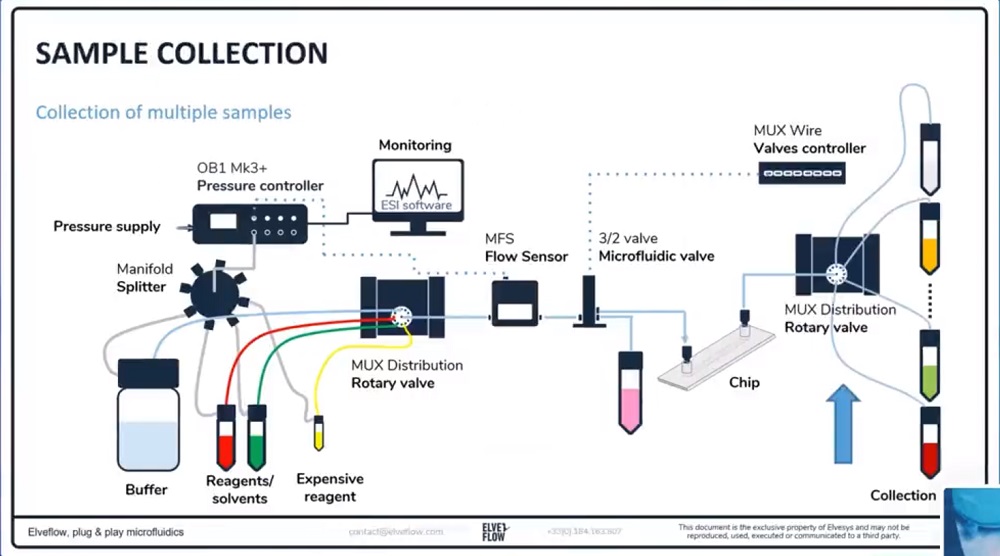
标准的活细胞灌注套装使用流量控制器OB1的一个压力输出通道将多种不同的溶液泵送入微流体芯片内。结合流量传感器MFS或者BFS,OB1流量控制器可以实现非常稳定的液体介质灌注。此外,使用MUX分配阀可以轻松切换液体介质,该MUX分配阀允许在10种溶液之间切换。使用一个图形界面操作软件ESI可执行所有液体切换操作。ESI软件允许您使用直观的scheduler模块对液体流量进行调节,并使实验自动化运行。
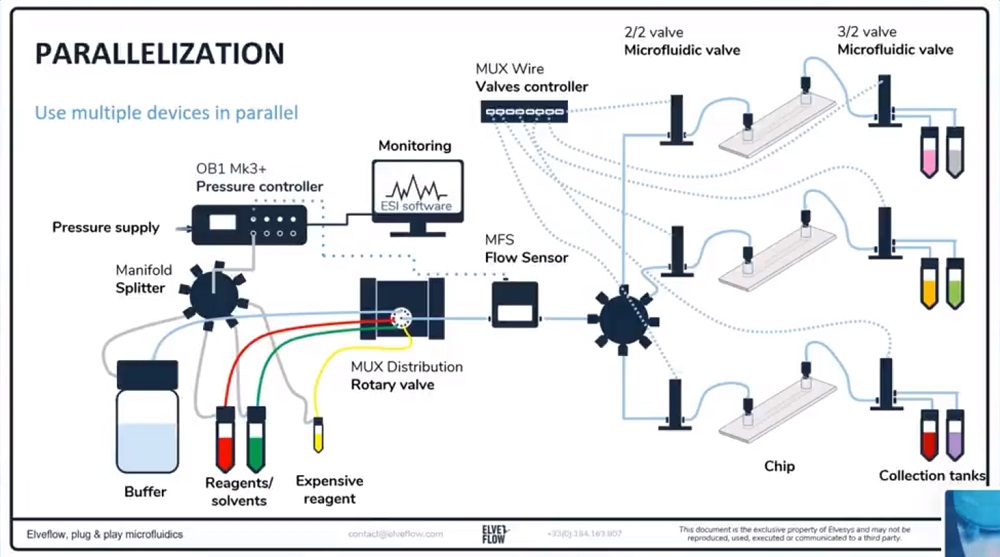
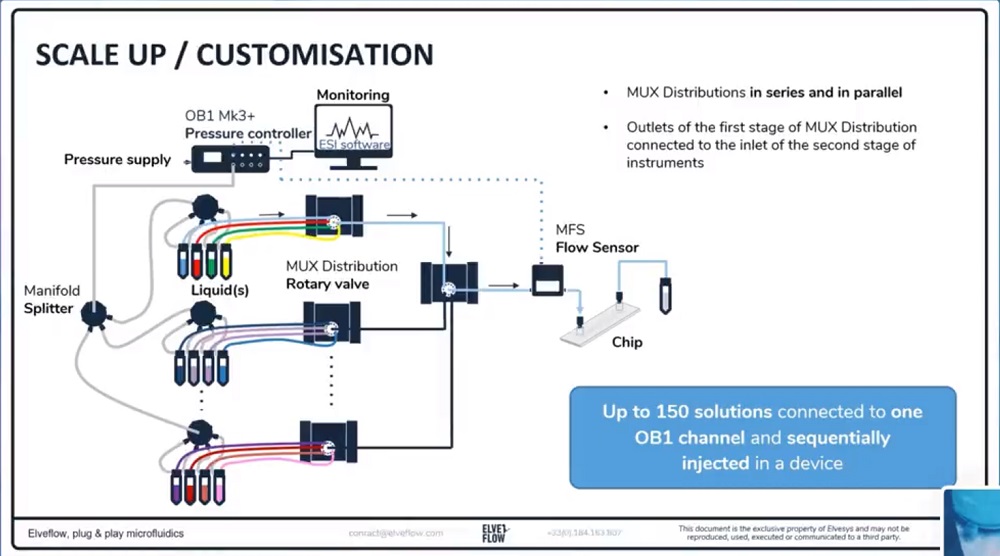
我们的专用套装可适用于更复杂和高级的细胞与生物学实验,例如使用20种溶液,选择正确的微流控芯片,去除气泡或多个芯片/入口的灌注。
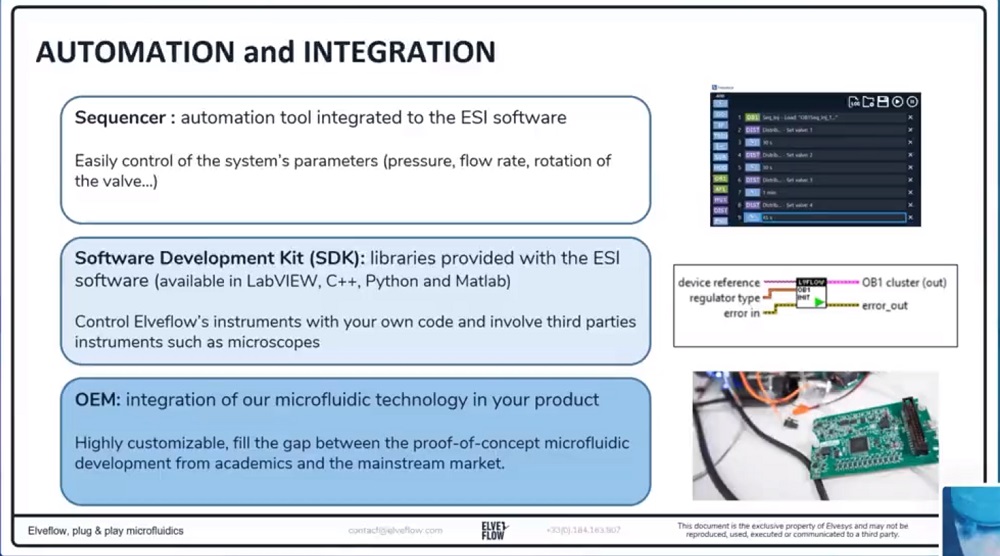
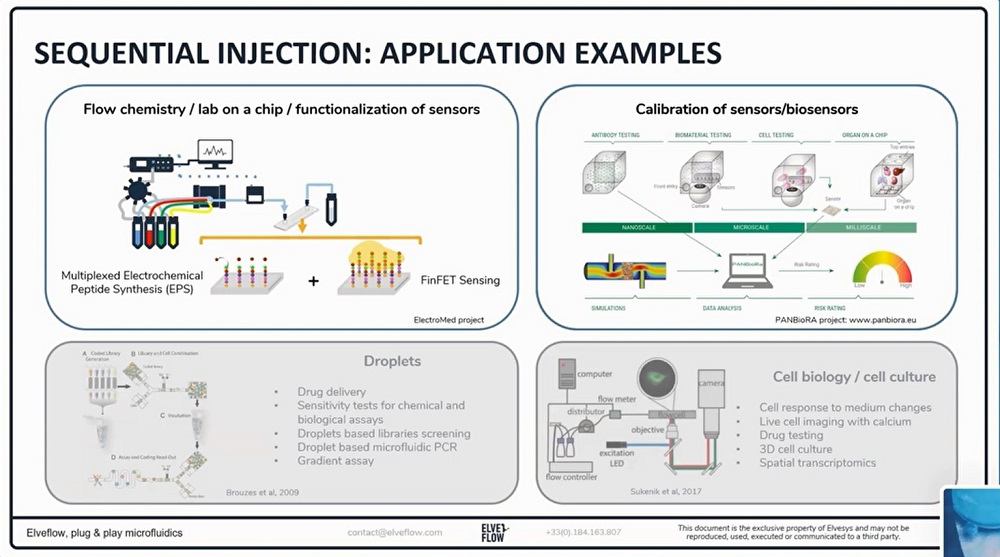
1、计算机:使用ESI软件控制所有参数,并通过创建进样序列,使您的实验自动化运行。
2、压力和流量控制器:施加给定的压力以便产生稳定且无脉动的流速。
3、分压歧管:使用分流器,可将压力和流量控制器OB1的一个通道的输出压力进行分压且同时施加到储液池的入口处。
4、储液池:盛放液体介质或者样品。从Eppendorf管道玻璃瓶,各种尺寸可供选择。
5、旋转阀:选择注入的液体
6、流量传感器:实时监控流量
7、灌注室或微流控芯片:细胞培养用微流控芯片
适用于所有Elveflow仪器的免费软件
——强大、模块化和多功能的实验装置控制的解决方案
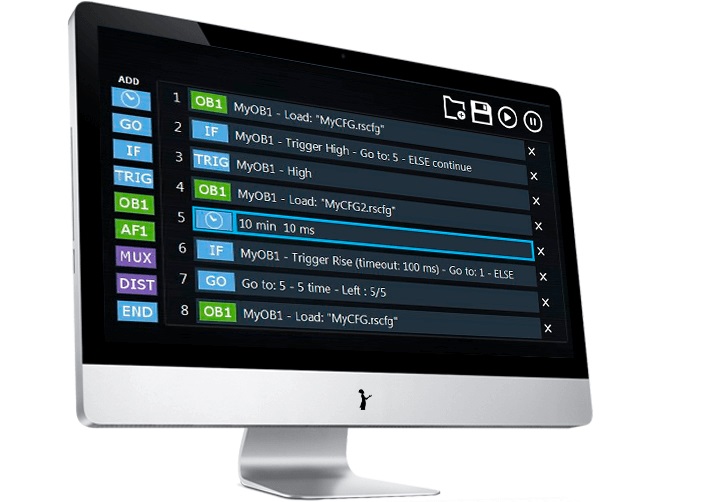
ESI操作软件可以通过同一个接口控制多达16台仪器。借助TTL触发器,您可以将Elveflow系统与实验室中使用的任何其他仪器(光学显微镜或任何电子仪器等)同步。Scheduler是一种用户友好的使用工具,可自动执行实验和方案的复杂步骤,节省您的宝贵时间。
体积注入模块
输入目标液体体积,该模块将在合适的时间自动调整流速以将液体注入。
流体系统优化模块
微流体实验系统路径的自动诊断功能,并给出改善建议,从而提高实验系统的流体流动性。
气泡检测模块

不再经受气泡的危害了!
传感器校准模块

在校准协议过程中,不要浪费宝贵的时间。
应用
(1)芯片上的细胞培养
(2)活细胞成像
(3)细胞对液体介质变换的响应
(4)药物筛选
(5)毒性测试
(6)干细胞实验
(7)钙成像
(8)3D细胞培养
(9)生物反应器研究
技术规格
标准的活细胞灌注套装包含以下组件
(1)1通道的压力和流量控制器OB1
(2)旋转阀MUX Distributor
(3)微流体流量传感器MFS
(4)样品储液池
(5)分压歧管
(6)导管和连接头
(7)软件和SDK库(C++、Python、MATLAB和LabVIEW)
微流控技术的诸多优势可以应用于许多细胞与生物学的应用,因此,可以调整活细胞灌注套装内的组件以适应您的特定需求。
可升级选项
(1)额外的压力和流量控制器OB1的通道
(2)额外的流量传感器BFS(直接测量,无需校准)
(3)微流控芯片
(4)电脑
(5)显微镜和相机
相关应用:
相关应用综述:
出版文献:
Critical Frequency and Critical Stretching Rate for Reorientation of Cells on a Cyclically Stretched Polymer in a Microfluidic Chip, Jiandong Ding et al., ACS Applied Materials & Interfaces (2021). DOI: 10.1021/acsami.0c21186
In vitro skin model for characterization of sunscreen substantivity upon perspiration, Fatemeh Keshavarzi et al., International Journal of Cosmetic Science (2021). DOI: 10.1111/ics.12703
Electrokinetic sandwich assay and DNA mediated charge amplification for enhanced sensitivity and specificity, Siddharth Sourabh Sahu et al. Biosensors & Bioelectronics (2021). DOI: 10.1016/j.bios.2020.112917
The method to dynamically screen and print single cells using microfluidics with pneumatic microvalves, Chang Chen et al., MethodX (2020). DOI: 10.1016/j.mex.2020.101190
Cyclic on-chip bacteria separation and preconcentration, Vitaly Ryzhkov et al., Scientific Reports (2020). DOI: 1038/s41598-020-78298-y
Synthetic Biology Bicistronic Designs Support Gene Expression Equally Well in vitro and in vivo, Owen Koucky et al., American Journal of Undergraduate Research (2020). DOI: 10.33697/ajur.2020.012
Zhu Z., Geng Y., Wang Y. (2021) Monitoring Single S. cerevisiae Cells with Multifrequency Electrical Impedance Spectroscopy in an Electrode-Integrated Microfluidic Device. In: Marchisio M.A. (eds) Computational Methods in Synthetic Biology. Methods in Molecular Biology, vol 2189. Humana, New York, NY. DOI: 10.1007/978-1-0716-0822-7_9
Investigating the Interaction Between Circulating Tumor Cells and Local Hydrodynamics via Experiment and Simulations
Pepona, M., Balogh, P., Puleri, D.F. et al. . Cel. Mol. Bioeng. (2020). DOI: 10.1007/s12195-020-00656-7
A drug-compatible and temperature-controlled microfluidic device for live-cell imaging, Open Biology; Jul, 2016; T. Chen et al; DOI : 10.1098/rsob.160156
A microfluidic gradient generator to simulate the oxygen microenvironment in cancer cell culture; Microelectronic Engineering; Aug, 2018; Louise Orcheston-Findlay et el; DOI : 10.1016/j.mee.2018.04.011
Geometric Friction Directs Cell Migration; Physical Review Letters; Jul, 2013; Le Berre et al; DOI : 10.1103/PhysRevLett.111.198101
An Integrated Microfluidic Chip and Its Clinical Application for Circulating Tumor Cell Isolation and Single‐Cell Analysis; Cytometry; Oct, 2019; Mingxin Xu et al; DOI : 10.1002/cyto.a.23902
Mitotic Rounding Alters Cell Geometry to Ensure Efficient Bipolar Spindle Formation; Developmental Cell; Apr, 2013; Oscar M. Lancaster et al; DOI : 10.1016/j.devcel.2013.03.014
微流体灌注系统的应用和规模化扩展示例